Larutan
2112009
Larutan adalah campuran homogen antara dua zat atau lebih. Komponen larutan yang jumlahnya lebih banyak disebut dengan pelarut atau solvent, sedangkan komponen larutan yang jumlahnya lebih sedikit disebut dengan zat terlarut atau solute. Jumlah relatif zat terlarut dalam suatu larutan disebut konsentrasi.
Berdasarkan daya hantar listriknya, larutan dibedakan menjadi 2, yaitu larutan elektrolit dan larutan nonelektrolit. Larutan elektrolit adalah larutan yang dapat menghantarkan arus listrik. Larutan elektrolit dapat menghantarkan arus listrik karena mengandung ion-ion yang dapat bergerak bebas. Ion-ion inilah yang pada dasarnya menghantarkan arus listrik tersebut. Ion-ion ini berasal dari ionisasi zat terlarut. Larutan nonelektrolit adalah larutan yang tidak dapat menghantarkan arus listrik. Larutan ini tidak mengandung ion-ion karena zat terlarutnya tetap sebagai molekul, tidak terurai menjadi ion-ion seperti halnya zat elektrolit. Bagaimana caranya mengetahui apakah suatu larutan bersifat elektrolit atau bukan?
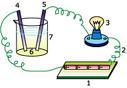 Alat di samping adalah alat sederhana yang dapat membedakan larutan elektrolit dan nonelektrolit. Alat ini terdiri: (1) sumber arus, (2) kawat penghantar, (3) lampu, (4) dan (5) dua batang elektrode, (6) larutan yang akan diuji, dan (7) gelas kimia sebagai wadah larutan. Dengan alat ini, larutan elektrolit dapat dikenali dari timbulnya gelembung gas pada kedua elektrode. Bila gelembung gas yang terbentuk banyak, larutan dikategorikan sebagai larutan elektrolit kuat. Ciri lain dari larutan elektrolit adalah lampu menyala terang. Bila gelembung yang terbentuk sedikit, larutan dikategorikan sebagai larutan elektrolit lemah. Karena daya hantar listriknya yang lemah, lampu akan menyala redup atau bahkan tdak menyala (saking redupnya). Kenapa timbul gelembung gas? Gelembung gas terbentuk karena arus listrik dapat memecah air menjadi gas hidrogen (H2) dan gas oksigen (O2). Peristiwa ini disebut sebagai elektrolisis yang dibicarakan pada bagian lain dari bolg ini. Larutan nonelektrolit dicirikan dari tidak adanya gelembung gas pada kedua elektrode. Karena larutan nonelektrolit tidak dapat menghantarkan listrik, tentu saja lampu indikator tidak akan menyala.
Alat di samping adalah alat sederhana yang dapat membedakan larutan elektrolit dan nonelektrolit. Alat ini terdiri: (1) sumber arus, (2) kawat penghantar, (3) lampu, (4) dan (5) dua batang elektrode, (6) larutan yang akan diuji, dan (7) gelas kimia sebagai wadah larutan. Dengan alat ini, larutan elektrolit dapat dikenali dari timbulnya gelembung gas pada kedua elektrode. Bila gelembung gas yang terbentuk banyak, larutan dikategorikan sebagai larutan elektrolit kuat. Ciri lain dari larutan elektrolit adalah lampu menyala terang. Bila gelembung yang terbentuk sedikit, larutan dikategorikan sebagai larutan elektrolit lemah. Karena daya hantar listriknya yang lemah, lampu akan menyala redup atau bahkan tdak menyala (saking redupnya). Kenapa timbul gelembung gas? Gelembung gas terbentuk karena arus listrik dapat memecah air menjadi gas hidrogen (H2) dan gas oksigen (O2). Peristiwa ini disebut sebagai elektrolisis yang dibicarakan pada bagian lain dari bolg ini. Larutan nonelektrolit dicirikan dari tidak adanya gelembung gas pada kedua elektrode. Karena larutan nonelektrolit tidak dapat menghantarkan listrik, tentu saja lampu indikator tidak akan menyala.
Zat terlarut apa saja yang dapat menghasilkan larutan elektrolit? Zat terlarut yang dapat membentuk larutan elektrolit meliputi asam, basa, dan garam. Asam kuat, basa kuat, dan sebagian besar garam akan menghasilkan larutan elektrolit kuat karena zat-zat ini dalam larutan akan terionisasi sempurna atau mempunyai derajat ionsisai (α) = 1. Contoh asam kuat adalah HCl, HBr, HI, H2SO4, HNO3, dan HClO4. Contoh basa kuat adalah NaOH, KOH, Ca(OH)2, Sr(OH)2, dan Ba(OH)2. Beberapacontoh garam adalah NaCl, K2SO4, CaCl2, KNO3, dan BaCl2. Larutan asam lemah dan basa lemah tergolong larutan elekrolit lemah karena zat terlaut dalam larutan ini hanya terionisasi sebagian. Contoh asam lemah adalah CH3COOH, H2S, HF, H2CO3, dan lain-lain. Contoh basa lemah adalah NH4OH, Al(OH)3, Fe(OH)3, dan lain-lain.
Zat-zat yang tidak tergolong asam, basa, dan garam akan menghasilkan larutan nonelektrolit bila dilarutkan ke dalam air. Contoh zat yang menghasilkan larutan nonelektrolit adalah urea, gula, dan alkohol.




Tidak ada komentar:
Posting Komentar